Orthopädische Hilfsmittel umfassen ein breites Spektrum, das von Implantaten und Instrumenten bis zu Rehabilitationsmitteln reicht. Um sicherzustellen, dass die in der EU benannte oder die im Vereinigten Königreich zugelassene Stelle für die Prüfung eines bestimmten Geräts qualifiziert ist, werden die Geräte nach dem Verwendungszweck oder den im Gerät verwendeten Technologien kategorisiert und gruppiert. Um dem Hersteller die Arbeit zu erleichtern, verwenden wir ein einheitliches Kodierungssystem für die EU und das Vereinigte Königreich. Die Zuordnung der Codes für die Hilsmittel erfolgt auf der Grundlage der öffentlich zugänglichen EU-MDR-Codeliste aus der Durchführungsverordnung (EU) 2017/2185 der Kommission vom 23. November 2017 und der Leitlinien der Medical Device Coordination Group Document MDCG 2019-14.
Bei orthopädischen Hilfsmitteln können diese Codes umfassen:
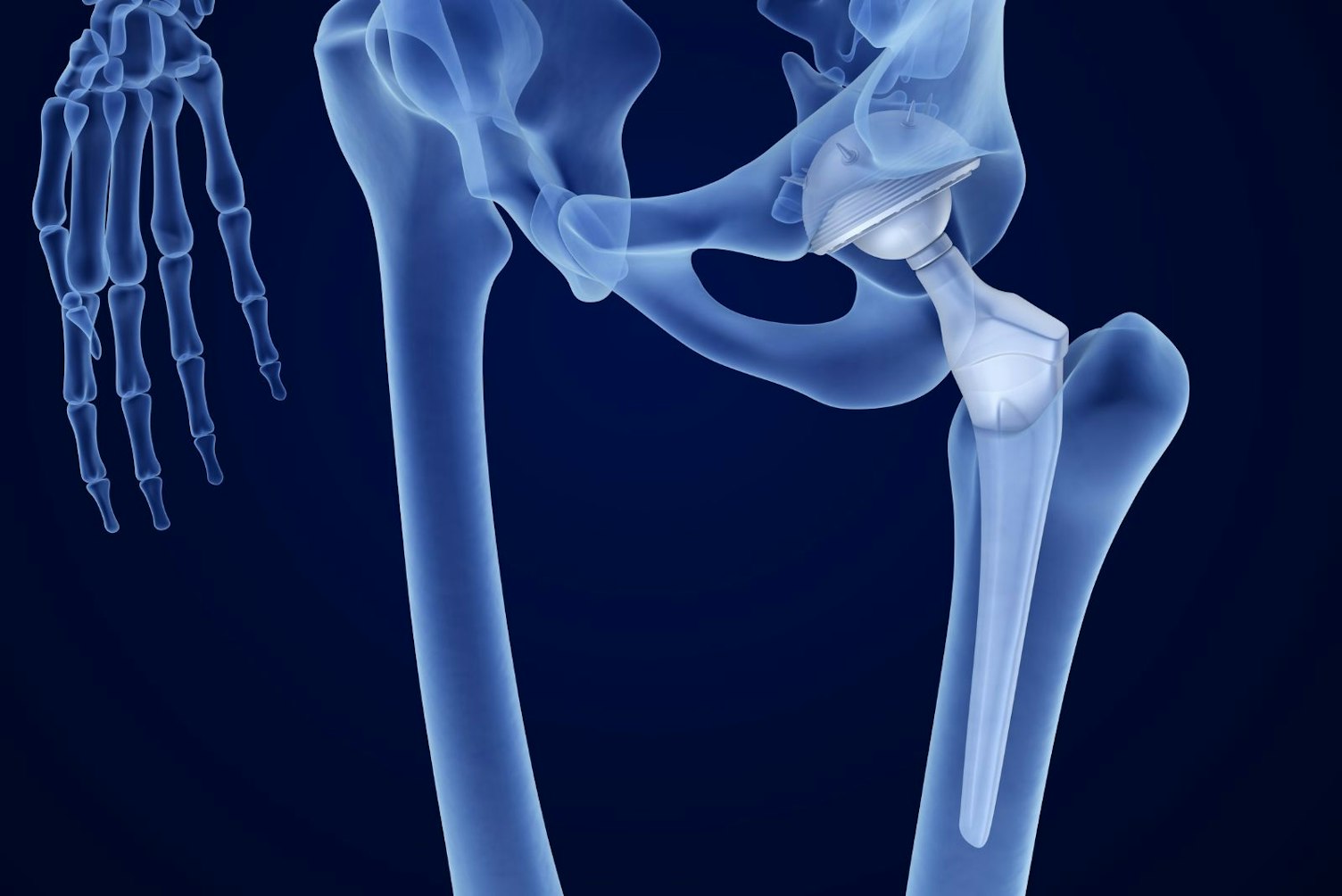
- MDN 1102: nicht-aktive osteo- und orthopädische Implantate. Dazu gehören:
- Gelenkersatz (Hüfte, Knie, Schulter, Knöchel) und Bandscheibenersatz
- Knochenersatz für orthopädische und kieferorthopädische Zwecke
- Nähte und Nahtanker
- Klammern für die orthopädische Chirurgie
- Distanzstücke
- Produkte für die Ligamentrekonstruktion
- Osteosynthesegeräte wie orthopädische Nägel, Schrauben und Platten
- MDN 1205: nicht-aktive, nicht implantierbare orthopädische und Rehabilitationsgeräte. Dazu gehören Geräte wie Orthesen, Krücken und Rollstühle, die für die Unterstützung der Patientenmobilität von entscheidender Bedeutung sind
- MDN 1208: Nicht aktive, nicht implantierbare Instrumente wie Pinzetten, Klemmen, Skalpelle, Reibahlen, Bohrer, Schlägel, Knochenlöffel, Küretten, Retraktoren, Elevatoren, Spatel und patientenspezifische Instrumente (PSI). Sie umfasst auch nicht-aktive Geräte, die in Verbindung mit arthroskopischen Geräten verwendet werden, wie z. B. Arthroskopie-Trokare
Um effiziente Konformitätsbewertungen zu unterstützen, werden Geräte auch nach der Europäischen Nomenklatur für Medizinprodukte (EMDN) für die EU oder der Global Medical Device Nomenclature (GMDN) im Vereinigten Königreich gruppiert, um orthopädische Hilfsmittel, die zusammen bewertet werden können, zu identifizieren und zu kategorisieren.