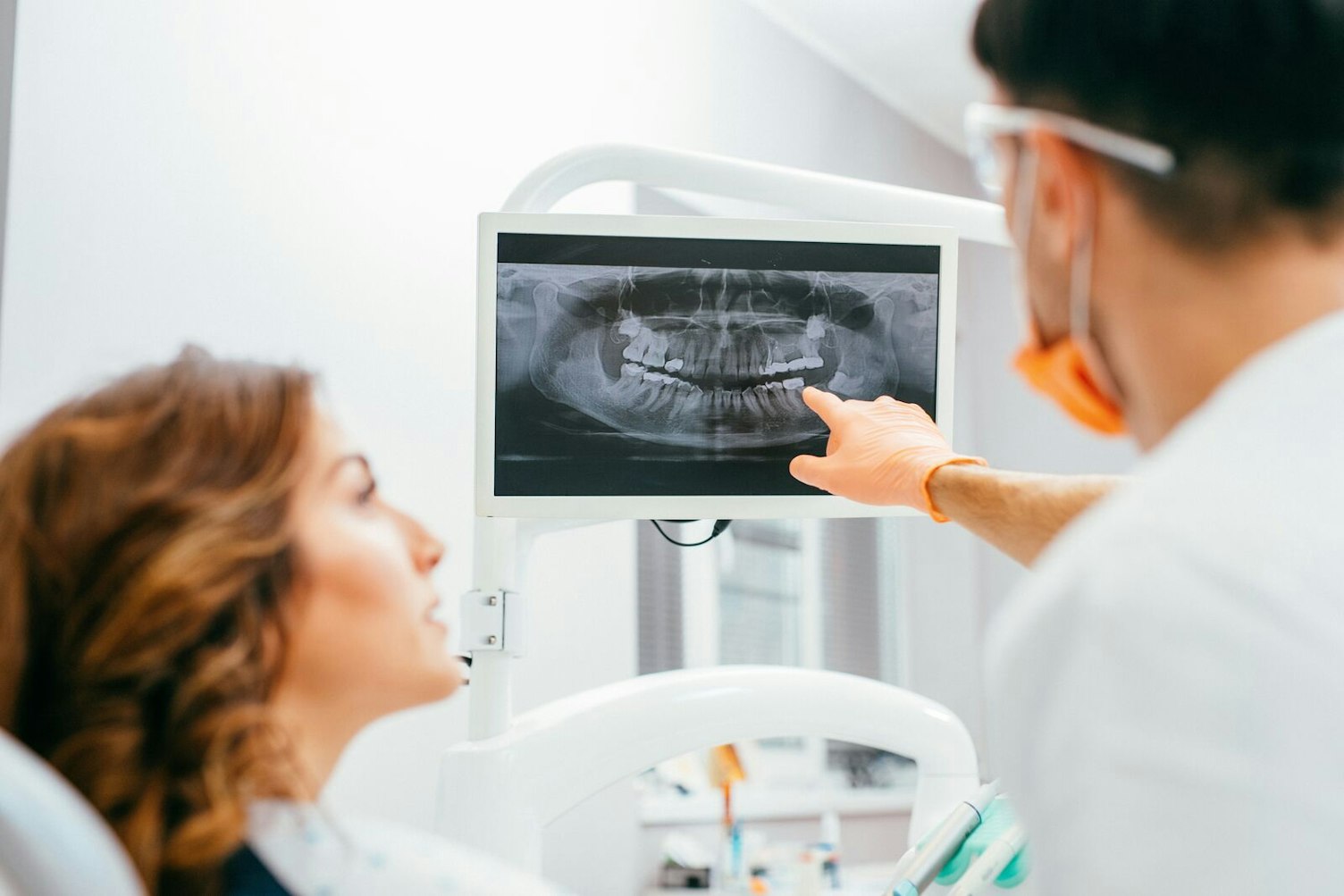
Zahnmedizinische Geräte decken ein breites Spektrum ab, das von Implantaten und Instrumenten bis hin zu Füllstoffen und Abformmaterialien reicht. Um sicherzustellen, dass die in der EU benannte oder die im Vereinigten Königreich zugelassene Stelle für die Prüfung eines bestimmten Geräts qualifiziert ist, werden die Geräte nach dem Verwendungszweck oder den im Gerät verwendeten Technologien kategorisiert und gruppiert. Um dem Hersteller die Arbeit zu erleichtern, verwenden wir ein einheitliches Kodierungssystem für die EU und das Vereinigte Königreich. Die Zuordnung der Codes erfolgt auf Basis der öffentlich zugänglichen MDR-Codeliste aus der Durchführungsverordnung (EU) 2017/2185 vom 23. November 2017. Dies wird durch das Dokument MDCG 2019-14 der Medical Device Coordination Group zur Identifizierung und Kategorisierung von Dentalprodukten näher erläutert. Dazu kann Folgendes gehören:
- MDN 1103: Nicht aktive Zahnimplantate und zahnmedizinische Materialien wie Zahnimplantate, Zahnfüller und permanente Wurzelkanalfüller aus Guttapercha, Abutments, Zahnkronen, Verblendschalen und Kompositkunststoffen, um nur einige zu nennen.
- MDN 1202: Nicht-implantierbare Produkte, die für die Verabreichung, Kanalisierung und Entfernung von Substanzen bestimmt sind. Sie umfasst u. a. die nicht aktiven Bestandteile von Absauggeräten oder Speichelsaugern.
- MDN 1208: Diese Kategorie umfasst nicht-aktive, nicht implantierbare Instrumente wie Zahnsteinentfernungsgeräte, Spiegel, Bagger, Poliergeräte und Küretten
- MDN 1209: nicht-aktive, nicht-implantierbare zahnmedizinische Materialien wie Ätzlösungen, Zahnspangen, Kurzzeitzemente und Abformmaterialien u. a.
Um effiziente Konformitätsbewertungen zu unterstützen, werden Produkte auch anhand der Europäischen Medizinprodukte-Nomenklatur (EMDN) für die EU oder der Global Medical Device Nomenclature (GMDN) im Vereinigten Königreich gruppiert, um Dentalprodukte zu identifizieren und zu kategorisieren, die gemeinsam bewertet werden können.