Autora:
Adriana Moura
Product Manager, Connectivity & Products, SGS Portugal
A nova legislação europeia para os dispositivos médicos, que entrou em vigor em 2017, tem em 2024 o final do seu período de transição.
Em artigos recentes temos abordado os novos Regulamentos 2017/745 e 2017/746, para dispositivos médicos e dispositivos médicos in-vitro, respetivamente, introduzidos pela Comissão Europeia com o intuito de assegurar a segurança dos pacientes e procurar dinamizar um mercado cada vez mais tecnológico e complexo.
Estes novos regulamentos entraram em vigor a 25 de Maio de 2017, com um primeiro período de transição a terminar a 26 de Maio de 2021, para todos os novos dispositivos e dispositivos sem uma certificação MDD/AIMDD válida. O final do período de transição alargado para os dispositivos conformes à certificação MDD/AIMDD termina a 26 de Maio de 2024, data a partir da qual todos os dispositivos médicos comercializados no mercado comunitário deverão obrigatoriamente cumprir com a totalidade dos requisitos dos Regulamentos CE 2017/745 e 2017/746.
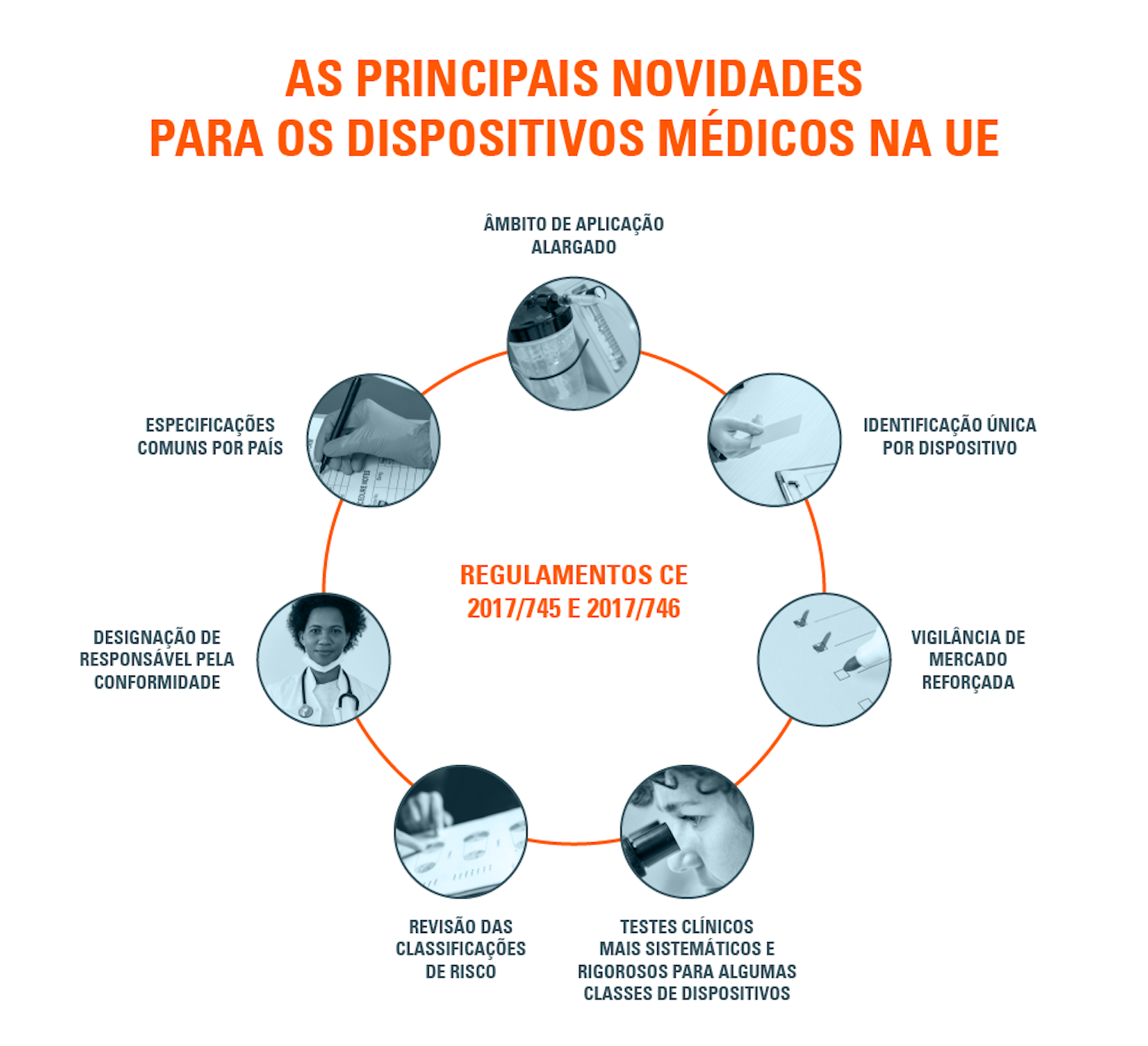
Quais são as principais novidades do regulamento UE para dispositivos médicos?
SE PRETENDE SABER MAIS SOBRE SEGURANÇA ALIMENTAR, DESCUBRA OS NOSSOS CURSOS >>
Para mais informações ou inscrições, por favor contacte:
t: +808 200 747 (Seg. a Sex. das 9h às 18h)
Sobre a SGS
Somos a SGS – a empresa líder mundial em testes, inspeção e certificação. Somos reconhecidos como referência global em sustentabilidade, qualidade e integridade. Os nossos 97.000 colaboradores operam numa rede de 2.650 escritórios e laboratórios e trabalham em conjunto para possibilitar um mundo melhor, mais seguro e interligado.
Polo Tecnológico de Lisboa,
Rua Cesina Adães Bermudes 5, Lote 11, 1600-604,
Lisboa,
Portugal